شیمیدانهای مدرن در تلاشند با جایگزین کردن کاتالیزورهای فلزی فراوان و سازگار با محیط زیست بهجای فلزهای ارزشمند به تولید دارو بپردازند.
کیمیاگرهای کهن تلاش میکردند سرب و دیگر فلزهای متداول را به طلا و پلاتین تبدیل کنند. امروزه شیمیدانهای مدرن در آزمایشگاه پاول چیریک در پرینستون در تلاشاند با یافتن جایگزینهای سازگار با محیط و ارزان برای فلزهای ارزشمندی مثل پلاتین، رودیوم و… وابستگی تولید دارو و صنایع داروسازی را به این فلزهای ارزشمند و ناسازگار با محیط از بین ببرند.
آنها به یک روش انقلابی برای تولید یک نوع داروی صرع رسیدهاند، در این روش بهجای رودیوم و دیکلرومتان (حلالهای سمی)، از کبالت و متانول برای تولید دارو استفاده میشود. واکنش جدید سریعتر و ارزانتر است و تأثیر کمی بر محیط دارد. به گفتهی چیریک، استاد شیمی دانشگاه ادواردز اس. سانفورد:
این یافته بر اهمیت شیمی سبز تأکید میکند، در شیمی سبز محلول سازگار با محیط به محلول شیمیایی ترجیح داده میشود. این کشف دارویی تمام عناصر سمی را در برمیگیرد. ما این برنامه را تقریبا ۱۰ سال پیش شروع کردیم که با هزینهی زیادی همراه بود. فلزهایی مثل رودیوم و پلاتین بسیار گرانقیمت هستند؛ اما با شروع کار فهمیدیم مشکلات ما فراتر از هزینه و سرمایهی مادی است. این آزمایش با نگرانیهای شدید محیطی همراه بود، استخراج پلاتین از زمین مستلزم حفر تا عمق یک مایلی زمین است و نشر انبوه کربندی اکسید را به همراه خواهد داشت.
چیریک و تیم پژوهشی برای یافتن روشهای سازگارتر با محیط و تولید مواد موردنیاز برای شیمی دارویی مدرن، با شیمیدانهای مؤسسهی Merck & Co همکاری کردند. این همکاری بهواسطهی یکی از برنامههای مؤسسهی ملی علوم با عنوان GOALI امکانپذیر شد.
از طرفی بسیاری از مولکولها در شکلهای راستگرد و چپگرد، عملکرد متفاوتی دارند و گاهی این واکنشها با پیامدهای خطرناکی همراه هستند. سازمان غذا و داروی آمریکا با اعمال محدودیتهایی تأکید دارد که داروها تنها یک جهت (راستگرد یا چپگرد) داشته باشند، به چنین داروهایی تک آنانتیومری گفته میشود.

انقلاب در شیمی سبز توسط شیمیدان های نوین
چیریک میگوید:
شیمیدانها بهدنبال روشهایی هستند که تنها یک جهت مولکولهای دارویی را ترکیب کنند (بهجای ترکیب هردو جهت و سپس جداسازی آن). کاتالیزورهای فلزی که قبلا از فلزهای ارزشمندی مثل رودیوم ساخته میشدند، به حل این مشکل میپردازند. این مقاله نشان میدهد میتوان از فلزهایی با فراوانی بیشتری مثل کبالت برای ساخت داروی صرع ازجمله کپرا استفاده کرد.
پنج سال پیش پژوهشگرها در آزمایشگاه چیریک نشان دادند میتوان از کبالت برای تولید مولکولهای تک آنانتیومری طبیعی استفاده کرد و بهجای ترکیبهای فعال و حلالهای سمی از ترکیبهای ساده برای تولید آنها استفاده کرد. تیم این آزمایش را روی نمونههای واقعی انجام داد تا نشان دهد کبالت نسبت به فلزهای ارزشمند، سازگاری بیشتری با محیط دارد.
سازگاری متانول با محیط از حلالهای کلری بیشتر است
آنها به این نتیجه رسیدند که روش جدید مبتنی برکبالت نسبت به روش رودیوم سریعتر است. بهگفتهی چیریک، این مقاله یک نمونهی نادر را نشان میدهند که در آن یک فلز با فراوانی زیاد نسبت در ترکیب داروهای تک آنانتیومری بهتر از فلزهای ارزشمند عمل میکند و قطعا استفاده از کاتالیزورهای فراوان در طبیعت بهجای فلزهای ارزشمند، مزایای زیستمحیطی و مادی زیادی را به همراه دارد. برای مثال میتوان به واکنشپذیری بهبودیافته و کاهش اثر محیطی اشاره کرد؛ البته ممکن است مزایای دیگری هم وجود داشته باشند که قبلا در هیچ نمونهای مشاهده نشدهاند.
فلزهای اصلی نهتنها ارزانتر هستند بلکه نسبت به فلزهای کمیاب، سازگاری بیشتری با محیط دارند، اما این روش جدید از متانول استفاده میکند که نسبت به حلالهای کلری موردنیاز رودیوم، با محیط سازگارتر است. چیریک میگوید:
تولید مولکولهای دارویی به دلیل پیچیدگی بالا یکی از پراتلافترین فرآیندها در صنایع شیمیایی است. عامل اصلی تولید ضایعات، نوع حلال بهکاررفته در واکنش است. روند و فرآیند تولید داروی به دیکلرومتان وابسته است که یکی از حلالهای ارگانیک دارای حداقل سازگاری با محیط است. پژوهش ما نشان میدهد کاتالیزورهای فراوان نهتنها در متانول (بهعنوان یک حلال سازگار) واکنش میدهند بلکه عملکرد بهینهای در این واسطه دارند.
این کشف یک پیشرفت انقلابی برای کاتالیزورهای فلزی فراوان است؛ زیرا درگذشته پایداری و مقاومت آنها بهاندازهی فلزهای ارزشمند نبود. پژوهش ما نشان میدهد هر دو واسطهی حلال و فلزی میتوانند بهصورت سازگار با محیط عمل کنند.
بهگفتهی مکس فردفلد مؤلف ارشد این مقاله و دانشجوی فارغالتحصیل آزمایشگاه چیریک، متانول یک حلال متداول برای ساختار شیمیایی تک جهتی است؛ اما اولین بار است که در یک سیستم کبالتی بهخوبی عمل میکند. میل ترکیبی کبالت با حلالهای سازگار با محیط شگفتانگیز است. چریک میگوید:
تقریبا به مدت ۱۰ سال، کاتالیزورهای فلزهای فراوان مثل آهن و کبالت برای واکنش به شرایطی با خلوص و خشکی بالا نیاز داشتند، این کاتالیزورها بسیار شکننده بودند. با واکنش در متانول نهتنها شکل محیطی واکنش بهبود پیدا کرد؛ بلکه استفاده از کاتالیزورها و کنترل آنها نیز آسانتر شد. این نتیجه کبالت را به رقیبی برای فلزهای ارزشمند تبدیل کرده که میتواند در بسیاری از کاربردها ازجمله هیدروژنهسازی مورداستفاده قرار بگیرد.

انقلاب در شیمی سبز توسط شیمیدان های نوین






 خرید واکس داشبورد
خرید واکس داشبورد شیونده خودرو نانو پودر تاچ لس محصولی بی نظیر و پرکاربرد
شیونده خودرو نانو پودر تاچ لس محصولی بی نظیر و پرکاربرد خرید بهترین محصولات کارواش و شوینده خودرو
خرید بهترین محصولات کارواش و شوینده خودرو شوینده خودرو نانوپودر تاچ لس شیمی صنعت تبریز
شوینده خودرو نانوپودر تاچ لس شیمی صنعت تبریز خرید شوینده خودرو ارزان
خرید شوینده خودرو ارزان هستهی زمین تنها ۱ میلیارد سال قدمت دارد
هستهی زمین تنها ۱ میلیارد سال قدمت دارد دانشمندان نظریهی جدیدی برای منشأ شکلگیری آب در زمین ارائه کردند
دانشمندان نظریهی جدیدی برای منشأ شکلگیری آب در زمین ارائه کردند تولید محصولات گوگل با مواد بازیافتی
تولید محصولات گوگل با مواد بازیافتی ثبت بزرگترین رکورد صاعقه در جهان به طول ۷۰۰ کیلومتر در برزیل
ثبت بزرگترین رکورد صاعقه در جهان به طول ۷۰۰ کیلومتر در برزیل تجزیه آب بوسیله نوعی الکترود و با کمک نانوذرات امکان پذیر شد
تجزیه آب بوسیله نوعی الکترود و با کمک نانوذرات امکان پذیر شد خرید محصول گرافن کوانتوم دات
خرید محصول گرافن کوانتوم دات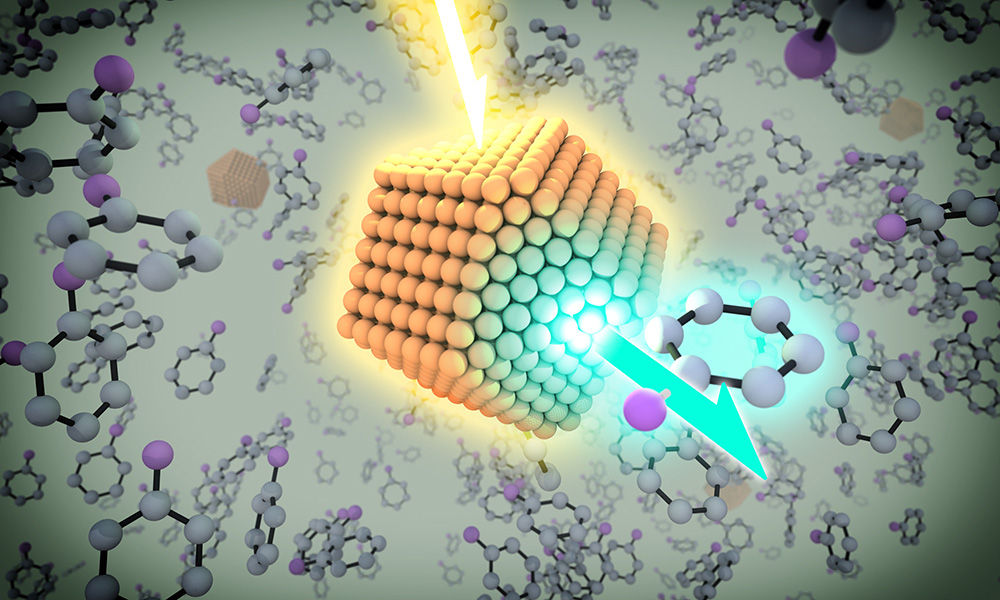 همه چیز درباره کوانتوم دات گرافن
همه چیز درباره کوانتوم دات گرافن معرفی و کاربرد محصول گرافن کوانتوم دات
معرفی و کاربرد محصول گرافن کوانتوم دات آب صابون نانو چیست؟
آب صابون نانو چیست؟ تولید نوعی پارچه با قابلیت خنثی سازی اثر تسلیحات شیمیایی
تولید نوعی پارچه با قابلیت خنثی سازی اثر تسلیحات شیمیایی روش های مختلف ماشین کاری و تاثیر آب صابون
روش های مختلف ماشین کاری و تاثیر آب صابون آب صابون , آب صابون نانو
آب صابون , آب صابون نانو چگونه مهارت تفکر استراتژیک خود را نمایش دهیم؟
چگونه مهارت تفکر استراتژیک خود را نمایش دهیم؟ رکوردشکنی جدید سلولهای خورشیدی ازنظر بازده
رکوردشکنی جدید سلولهای خورشیدی ازنظر بازده تبدیل گاز گلخانه ای به انرژی پاک
تبدیل گاز گلخانه ای به انرژی پاک کشف دانشمندان کره افزایش ظرفیت باطری خودروهای برقی
کشف دانشمندان کره افزایش ظرفیت باطری خودروهای برقی روش بهینه تولید هیدروژن برای نخستین بار مورد آزمایش قرار گرفت
روش بهینه تولید هیدروژن برای نخستین بار مورد آزمایش قرار گرفت معمای پیوند کربن-کربن بعد از 120 سال پیدا شد
معمای پیوند کربن-کربن بعد از 120 سال پیدا شد پنجمین نیروی طبیعت توسط پژوهشگران کشف شد
پنجمین نیروی طبیعت توسط پژوهشگران کشف شد کارآفریی چیست و راهکارهای موفقیت در کارآفرینی
کارآفریی چیست و راهکارهای موفقیت در کارآفرینی معرفی بهترین محصول شوینده خودرو
معرفی بهترین محصول شوینده خودرو چرا یادگیری مستمر برای کارآفرینان ضروری است؟
چرا یادگیری مستمر برای کارآفرینان ضروری است؟